







Kalliopi-Anna Poulia
Dr, MSc, PhD
Clinical Nutritionist-Dietitian
Laiko General Hospital of Athens, Greece
lpoulia@gmail.com
10.0 Ernährungsmanagement in der Heim Hämodialyse
Lernziele
- Verstehen der Bedeutung der Ernährung für Menschen in der HHD
- Identifizieren des Nährstoffbedarfs eines Patienten mit CKD Stadium 5
- Identifizieren des Nährstoffbedarfs bei Menschen mit häufigerer HHD im Gegensatz zur CHD
- Identifizieren, wie allgemeine Ernährungsprobleme bei Patienten mit HHD bewältigt werden können
Einleitung
Ernährungsintervention ist bei Menschen mit CKD sehr wichtig, für den Outcome der Erkrankung und zur Prävention einer Fehl- oder Mangelernährung. Malnutrition ist ein generelles Problem, das eine Dysbalance in der Nährstoffversorgung kennzeichnet. Das können Defizite, ein Übermaß oder eine generelle Dysbalance sein. Es betrifft den Energiegehalt, Eiweiß und andere messbare unerwartete Effekte auf die Körperform (Gestalt, Größe und Zusammensetzung), Funktion und klinisches Outcome1. Der erste und am meisten bedeutsame Typ ist Eiweiß-Energie Malnutrition (PEM) oder Protein-Energy Wasting (PEW). Sie wird definiert als eine Mangelversorgung mit Energie oder Eiweiß, um den Stoffwechselmetabolismus aufrecht zu erhalten2. Die Gründe für eine Malnutrition sind:
- Eine inadäquate Nahrungsaufnahme als Folge von Erbrechen durch die Urämie und einen veränderten Geschmack.
- Erhöhter Verbrauch durch die Erkrankung oder ein akutes Geschehen.
- Beeinträchtigungen bei der Nahrungszubereitung.
- Wenig schmackhafte Diätvorschriften (wenig Salz, Flüssigkeitsbeschränkung, wenig Kalium, wenig Phosphat).
- Die Dialysebehandlung selbst führt zum Verlust von Nährstoffen (Aminosäuren, wasserlösliche Vitamine, usw.).
- Ein gesteigerter Umsatz durch chronische Entzündungen.
- Endokrine Störungen durch die Urämie3,4.
Eine detaillierte Ernährungsanamnese ist unerlässlich, um für alle CKD-Stadien die optimale Versorgung erzielen zu können. Klassischerweise gibt es drei große Richtungen, den Eiweiß-Energie Ernährungsstatus zu erheben, z.B. biochemische Messungen, Ernährungsprotokoll und Körperzusammensetzung.
Eiweißaufnahme ist sehr wichtig, weil es durch die HD zu einem Eiweißverlust kommt. Eine ausreichende Aufnahme von biologisch hochwertigem Eiweiß sollte sichergestellt sein. Gleichzeitig ist es unerlässlich, zur Phosphatkontrolle den richtigen Phosphatbinder einzunehmen. Eine Beschränkung der Salzzufuhr ist wichtig für die Kontrolle von Durst, Flüssigkeitsaufnahme und letztlich zur Blutdruckkontrolle. Die Kontrolle der Kaliumzufuhr ist sehr bedeutend. Sie kann hauptsächlich durch die Restriktion von kaliumreichen Lebensmitteln erreicht werden, wie Früchte und Gemüse.
Das Ernährungsmanagement von Patienten in der HHD ist abhängig von der Art der HHD, die sie durchführen. Für Patienten, die drei Mal pro Woche dialysieren, sind die Vorschriften die Gleichen wie bei der CHD. Werden Frequenz und Dauer der wöchentlichen HHD erhöht (SDHD, nächtliche Heim Hämodialyse (NHD)), werden mehr Stoffwechselendprodukte ausdialysiert. So können die meisten der Ernährungsvorschriften, die die CHD betreffen, reduziert werden.
10.1 Biochemische Kontrolle bei höher frequenter Hämodialyse
Wegen der Prävalenz der Malnutrition nach Beginn der HD ist es sinnvoll, ein Basismonitoring des Ernährungsstatus durchzuführen. Zu Beginn der HHD kann der Ernährungsstatus von den Vorschriften an der CND oder auch von restriktiven Diätvorschriften aus den früheren CKD-Stadien negativ beeinflusst sein.
Ungewollter Gewichtsverlust, 5% des Körpergewichts in 3 Monaten, wird als signifikant bezeichnet und sollte Anlass zur Reaktion sein, um eine Malnutrition zu verhindern. Darüber hinaus sollten verminderter Appetit, erniedrigte Spiegel von Phosphat, Cholesterin und Albumin frühzeitig erkannt werden. Patienten sollten angehalten werden, mehr Energie und Eiweiß zu sich zu nehmen.
Übereinstimmend mit verfügbaren Forschungsdaten sehen wir, dass sich schon ein paar Wochen nach Beginn der FHHD der Appetit verbessert und damit auch die Nahrungsaufnahme besser wird. Das kann an steigendenAlbuminwerten abgelesen werden. Der Ernährungsstatus verbessert sich ebenfalls5,8. Der Ernährungsstatus sollte überwacht werden, um frühzeitig Veränderungen zu erkennen und eine Ernährungstherapie einleiten zu können. Tabelle 10.1 gibt eine Übersicht über das Monitoring.
Leitlinien können variieren und jede Dialyseeinheit wird ihren eigenen Leitlinien folgen. Die KDOQI Leitlinien für CKD-Pflege benennen folgende klinische Maker als hilfreich zur Identifikation von Eiweiß-Energie Unterversorgung: Serumalbumin <4 g/dl, Pre-Albumin <30 mg/dl, Kreatinin <10 mg/dl und Cholesterin <150 mg/dl. Die International Society of Renal Nutrition and Metabolism geht von einem Serumalbumin <3,8 g/dl aus, als eins von drei biochemischen Diagnostikkriterien für Protein-Energy Wasting (zwischen Transthyretin und Cholesterinspielgel)10. Bezogen auf die EBPG Leitlinien für Ernährung11 sollte der BMI >23kg/m2 bei Hämodialysepatienten sein. Diese Parameter sollten regelmäßig überwacht werden, z.B. einmal monatlich, um den Ernährungsstatus des Patienten zu erheben und seine Ernährungsbedürfnisse und Outcome zu erfassen.
Tabelle 10.1: Empfohlene Monitoringstrategien für den Ernährungsstatus und Anleitung zur Therapie bei fortgeschrittener CKD12.
| Basiswerte (monatlich) | Befunde | Möglichekiten der Intervention |
| Körpergewicht/ideales Körpergewicht Serumalbumin Serum Kreatinin |
Kontinuierliche Abnahme oder<85% IBW <4.0 g/dl vor Dialyse relative niedrig |
vermutlich PEW, Erhebung von Details Ernährungsstatus erheben Präventive Maßnahmen durchführen |
| Detailierte frühe Erhebungen | Befunde | Möglichkeiten der Intervention (einfach) |
| Serumprealbumin Serumtransferrin Niedriges Körpergewicht und/oder Körperfett SGA |
<30mg/dl und/oder <200mg/dl und/oder unerwünschte Abnahme Verschlechterung |
Ernährungsberatung: Eiweißaufnahme 1.2g/ kg/d, Ernergieaufnahme 30-35 kcal/Tag Dialysedosis auf KtN>1.4 erhöhen Biokompatible Membranen benutzen Obere Magem-Darmpassage verbessern |
| Wiederholung der detaillierten Erhebungen (2-3 monatlich) | Befunde | Möglichkeiten der Intervention (umfangreicher) |
| Serumprealbumin Serumtransferrin Niedriges Körpergewicht und/oder Körperfett C-reactive Protein |
<30mg/dI und/oder <200mg/dl und/oder unerwünschte Abnahme >10 mg/I |
Ernährungsunterstützung (oral) Substitution, enterale Ernährung, IDPN wenn erforderlich Aufbauende Substanzen Appetit anregen (experimentell) Entzündungshemmer (experimentell) |
10.2 Nahrungsaufnahme – weniger Medikamente bei mehr diätetischer Freiheit
Wegen der zunehmenden Dialysehäufigkeit bei der FHHD kann bei den Patienten eine Verbesserung der „physiologischen“ Funktionen beobachtet werden, weil mehr Stoffwechselendprodukte durch die Dialyse entfernt werden. Konsequenterweise können die Ernährungsvorschriften im Vergleich zur CHD für diese Patienten gelockert werden. Hauptsächlich können die Restriktionen bei den Elektrolyten, Kalium und Phosphat, und der Flüssigkeitszufuhr in Abhängigkeit von den Blutwerten gelockert werden. FHHD Patienten zeigten in der KIHDNEycohort Studie stabilere Werte im Mineral- und Knochenstoffwechsel bei weniger Einschränkungen in ihrer Ernährung. Mehr Patienten wiesen einen Phosphatspiegel im Normbereich auf und eine signifikante Verbesserung des Bicarbonatspiegels vor der Dialyse24.
Die Nahrungsaufnahme kann in kcal für die Energie oder in g für die Eiweißaufnahme gemessen werden, angegeben als kcal/kg/Tag oder g/kg/Tag.
10.2.1 Energieaufnahme
Eine ausreichende Energiezufuhr ist wichtig für eine positive Stickstoffbalance. Eine Energieaufnahme von 35 kcal/kg/d ist verbunden mit einer besseren Stickstoffbilanz und hilft bei CKD Patienten das Körpergewicht ±10% stabil zu halten13. Die empfohlene Energieaufnahme für klinisch stabilen CKD Patienten beträgt zwischen 30-40 kcal/kg/d, angepasst an das Alter, Geschlecht und Status der körperlichen Aktivität. Für Patienten über 60 Jahre oder Übergewichtige sollte die Energieaufnahme nicht über 30 kcal/kg/d liegen9,11,14.
Übergewichtige oder unterernährte Patienten benötigen eine Anpassung der Energieversorgung an ihre Bedürfnisse. Die Energiezufuhr bei > 60-jährigen sollte 30 kcal/kg/d wegen des niedrigen Energiebedarfs und der häufig fehlenden Bewegung im Alltag nicht überschreiten9. Regelmäßige körperliche Aktivitäten sollten gefördert werden, um die Muskelfunktionen aufrechtzuerhalten, die Ausdauer und die kardiovaskuläre Gesundheit zu verbessern.
10.2.2 Eiweißaufnahme
Die Eiweißaufnahme bei Dialysepatienten sollte höher liegen als bei normal gesunden Menschen, weil durch die Dialysetherapie selbst ein Eiweißverlust eintritt. Besonders Aminosäuren, Oligopeptide, wasserlösliche Vitamine und Spurenelement gehen über die Dialysemembran verloren. Außerdem verursacht die Dialysetherapie selbst katabolen Stress, setzt proinflamatorische Cytokine frei, die wiederum den Eiweißbedarf erhöhen15.
Gemäß den verfügbaren Leitlinien:
- Die empfohlene Eiweißaufnahme bei klinisch stabilen Hämodialysepatienten sollte zwischen 1,0 – 1,5 g/kg/d liegen und bei nPNA 1,0 g/kg/d betragen.
- Die optimale Eiweißzufuhr für einen aktuell erkrankten liegt bei 1,2 – 1,3 g/kg/d4,11.
- Speziell für Patienten an der HHD spielt die Eiweißversorgung mit Zunahme der Dialysefrequenz und damit verbundenem erhöhtem Eiweißverlust eine besondere Rolle.
Die höheren Angaben zum Eiweißbedarf finden Anwendung bei FHHD Patienten. Es wurde berichtet, dass die Eiweißaufnahme mit Erhöhung der Dialysedosis ansteigt, ohne dass es zu einer Zunahme des Phosphatspiegels im Blut kommt, trotz Reduktion der Phosphatbinderdosis16. Die Eiweißaufnahme spielt eine bedeutende Rolle und sollte engmaschig Überprüft und an die Bedürfnisse der Patienten angepasst werden.
Das aufgenommene Eiweiß sollte eine hohe biologische Wertigkeit aufweisen, Beispiele für tierische Quellen: Geflügel, Fleisch, Eier, Soja, Frischkäse usw. An der FHHD kann phosphathaltiges tierisches Eiweiß (kleine Fische, Milcherzeugnisse, Käse) üblicher Weise großzügiger verzehrt werden, verglichen zur CHD, da die Abbauprodukte besser entfernt werden. Bei einer schlechten Phosphatbilanz sollte der Verzehr von phosphathaltigen Eiweißprodukten limitiert werden und nur in Verbindung mit Phosphatbindern verzehrt werden. So kann die direkte Aufnahme von Phosphat aus dem Darm schon effektiv verhindert werden.
Werden geschmackliche Veränderungen bei Aufnahme von tierischem Eiweiß berichtet (metallischer Geschmack), sollten Alternativen für biologisch hochwertiges Eiweiß gegeben werden. Auch die Substitution von Eiweißpräparaten kann eine Möglichkeit sein, die sinkende Zufuhr zu verhindern.
10.2.3 Fettaufnahme
Die CKD ist ein Grund für die Entwicklung kardiovaskulärer Erkrankungen17, hauptsächlich wegen der Entzündungen, einer gestörten Kalzium-Phosphat-Ratio und vorbestehenden Risikofaktoren wie Diabetes mellitus. Aus diesen Gründen sollten alle ernährungsbedingten Risikofaktoren in Betracht gezogen werden18,19.
- Gesättigte Fettsäuren sollten auf <10% der Gesamtenergieaufnahme begrenzt werden.
- Cholesterin <250 mg/d.
- Einfach ungesättigte Fettsäuren sollten 10-20% der Gesamtenergieaufnahme ausmachen (TEE).
- Mehrfach ungesättigte Fettsäuren sollten ca. 10% der TEE ausmachen.
Quellen für gesättigte Fette, wie Vollfett Milch, Käse, fettes Fleisch, Geflügel mit Haut, Frittiertes, Butter und Vollfettfrischkäse sollten gemieden werden und durch Olivenöl, als einer der Hauptlieferanten für Fett ersetzt werden. Eine Empfehlung gibt es für ω-3 Fettsäuren, die speziell Patienten mit FHHD zu sich nehmen sollten, für eine bessere Phosphatkontrolle. Fetter Fisch wie Kabeljau oder Lachs sollte einmal pro Woche auf dem Speiseplan stehen. Bei Patienten mit schlechten Phosphatwerten sollte unbedingt auf die Einnahme der Phosphatbinder zum Fisch geachtet werden.
10.2.4 Vitamine und Spurenelemente
Dialysepatienten sind gefährdet, einen Vitaminmangel zu erleiden. Das ist zurückzuführen auf einen unnormalen renalen Metabolismus, ungenügende Aufnahme über die Nahrung auf Grund der Ernährungseinschränkungen, einen Verlust durch schlechte Resorption aus dem Magen-Darmtrakt und den Verlust durch die Dialysetherapie. Der Verlust durch die Dialyse ist abhängig von der Dialyseart und Dauer. Seit dem Einsatz von High-Flux Dialysatoren und der Durchführung von High-Efficiency Dialysen ist der Verlust durch die Therapie zurückgegangen. Ein Vitaminmangel entwickelt sich langsam, kann aber die Lebensqualität der Patienten beeinflussen. Der Vitaminstatus jedes einzelnen Patienten sollte in Abhängigkeit von Alter, Geschlecht, Aufnahme über die Nahrung, Verlust durch die Dialyse, Nierenrestfunktion und Art der Dialyse bestimmt werden, bevor eine Substitutionstherapie begonnen wird11. Der Blut-Vitaminstatus verbunden mit einer frühzeitigen Erkennung von Vitaminmangelsymptomen sind wichtig für eine individualisierte Therapie.
10.2.4.1 Wasserlösliche Vitamine
Während der Hämodialyse gehen größere Mengen über das Dialysat verloren. In der CHD treten durch die Einschränkungen in der Kaliumzufuhr und damit verbunden, mit einer verringerten Aufnahme von Obst und Gemüse, zu einem Defizit an Folsäure und Vitamin C. Eine Folsäurezufuhr (1mg-5mg) ist wichtig für die Prävention einer Hyperhomocysteinämie. Vitamin C (75mg-90mg) sollte ebenfalls zugeführt werden, wegen der verringerten Aufnahme von frischem Obst und Gemüse11.
Auch ein Thiaminmangel sollte wegen des Auswaschens durch die Dialyse und einer zu geringen Aufnahme durch die Nahrung ersetzt werden. Thiaminquellen sind Kerne/Saaten, Hülsenfrüchte und Schweinefleisch. Beriberi ist die am besten bekannte Erkrankung auf Grund eines Thiaminmangels. Eine andere Manifestation betrifft die Wernicke Encephalopathie mit neurologischen Symptomen. Gegenwärtig enthalten alle Vitaminkombinationen für Dialysepatienten Thiamin11.
Ein Riboflavinmangel ist nicht häufig, auch wenn es durch die Dialysetherapie regelmäßig entfernt wird. Ribiflavinquellen sind mageres Fleisch, Eier, Cerealien und Brot. Alle Lebensmittel sind Bestandteil der Ernährungsempfehlungen für CKD Patienten. B6 kann zusätzlich benötigt werden, wenn durch die Gabe von Erythropoetin die Blutbildung angeregt wird. B12 wird benötigt, zur Vorbeugung der perniziösen Anämie und für einen optimalen Folsäuremetabolismus. Es ist in ausreichender Menge in Fleisch, Milch und Eigelb enthalten. Bei Nierenpatienten ist die Substitution sicher und die Aufnahme gewöhnlich nahe der DRI11.
Die Empfehlungen für die Vitaminaufnahme und Substitution bei Hämodialysepatienten sind in Tabelle 10.2. zusammengefasst. Es gibt keine speziellen Empfehlungen für FHHD Patienten. Zukünftig sind dazu weiter Studien nötig, um zu untersuchen, ob es Unterschiede im Vitaminbedarf zwischen den verschiedenen Arten und Frequenzen der Dialysetherapien gibt.
10.2.4.2 Fettlösliche Vitamine
Die fettlöslichen Vitamine sollten mit Vorsicht betrachtet werden. Sie werden im Körper gespeichert und das Risiko einer Toxizität ist höher. Vitamin A Mangel ist bei Dialysepatienten selten, weil das Vitamin nicht ausdialysiert wird. Aus diesem Grund ist die Gefahr der Toxizität hoch und eine Substitution ist nicht angeraten. Der tägliche Bedarf kann durch die Nahrung gedeckt werden, wie Milcherzeugnisse, Fischöl und Karotten. Bezüglich Vitamin K gibt es Evidenz für einen Defizit bei CKD Patienten, die die Ernährungsvorgaben einhalten11.
Tabelle 10.2. Empfohlene Aufnahme und Substitution von Vitaminen11
| Vitamin | Tägliche Empfehlungen |
|---|---|
| Wasserlösliche Vitamine | |
| Thiamin (B1) | 1.1-1.2 Substitution |
| Riboflavin (B2) | 1.1-1.3 Substitution |
| Niacin (B3) | 14-16mg Substitution |
| Pantothenic Acid (B5) | 5 mg Substitution |
| Pyridoxine (B6) | 10 mg Substitution |
| Biotin (B8) | 30 μg Substitution |
| Folsäure (B9) | 1-5 mg Substitution |
| Cobalamine (B12) | 2.4 mg Substitution |
| Vitamin C | 75-90 mg Substitution |
| Fettlösliche Vitamine | |
| Vitamin A | 700-900 μg Aufnahme — keine Substitution |
| Vitamin K | 90-120 μg - keine Substitution |
| Vitamin E | 400-800 IU Substitution für sekundäre CVD Prävention und Krämpfe |
10.2.5 Elektrolyte und Mineralien
10.2.5.1 Salz und Flüssigkeit
Eine Einschränkung der Salzaufnahme ist für alle Stadien der CKD indiziert. Die Salzaufnahme ist essentiell für die Kontrolle des extrazellulären Volumens und für eine bessere Kontrolle des arteriellen Blutdrucks. Bei der HD ist die Salzkontrolle um so bedeutender, weil es eng mit der Compliance bei der Trinkmenge und der Prävention der Flüssigkeitsüberladung im dialysefreien Intervall bei Anurie und Oligurie verbunden ist, sowie den Durst beeinflusst. Salzersatz mit Kaliumchlorid sollte für HD Patienten vermieden werden. Salz kann durch Kräuter und Gewürze ersetzt werden. Salz sollte auf eine Zufuhr von höchstens 80-100 mmol (2000-3000 mg) oder 5-6 g (75 mg/kg/d) begrenzt werden.
Die Flüssigkeitsaufnahme ist bei FHHD Patienten großzügiger, weil über die Woche auch mehr Flüssigkeit entfernt werden kann.
Viele Patienten können die Trinkmange von 500-1000 ml wegen ihrer Restausscheidung überschreiten. Es gibt keine strikten Empfehlungen für die Trinkmenge bei FHHD Patienten. Ziel ist aber eine Kontrolle der intradialytischen Gewichtszunahme11.
Viele Patienten können die Trinkmange von 500-1000 ml wegen ihrer Restausscheidung überschreiten. Es gibt keine strikten Empfehlungen für die Trankmenge bei FHHD Patienten. ZielistabereineKontrolle der intradialytischen Gewichtszunahme11.
Für Patienten, denen es schwerfällt, die Trinkmenge zu kontrollieren, sollten alle Lebensmittel, die bei Raumtemperatur (18-20°) flüssig sind, als Flüssigkeit gezählt werden, ausgenommen Öle. Der Durst kann mit der Salzreduktion etwas gemildert werden. Durch den Verzehr von gekühlten Getränken, Eiswürfel an Stelle von Wasser, dem Zusatz von Zitrone zum Wasser und das Kauen von Kaugummi kann die Schleimhaut im Mund befeuchtet werden20, 21.
10.2.5.2 Kalium
Physiologisch warden 90% des Kaliums über die Nieren ausgeschieden. Die Beschränkung der Aufnahme und eine adäquate Dialysetherapie können zu einem akzeptablen Kaliumspiegel verhelfen. Kalium ist in fast allen Nahrungsmitteln enthalten. Aus diesem Grund sollten Restriktionen limitiert werden, um einer Balance zwischen der Kaliumaufnahme und der Lebensqualität des Patienten zu erhalten.
Die Mehrzahl der FHHD Patienten haben einen eher normalen Kaliumspiegel. So kann die Ernährungsempfehlung für Kalium liberaler ausfallen, bezogen auf den Verzehr von Obst und Gemüse. Die Aufnahme von Ballaststoffen ist ebenfalls einfacher an die empfohlene Menge anzupassen, um Obstipation vorzubeugen. Bei CKD Patienten ist die Kaliumausscheidung erhöht, als Kompensationsmechanismus. Die Vorbeugung einer Obstipation ist auch als Prävention einer Hyperkaliämie zu sehen.
Hyperkaliämie verursacht Übelkeit, Schwäche, Taubheit oder Kribbeln, langsamen Puls, Extrasystolen und ein hohes Risiko von Herzerkrankungen und plötzlichem Herztod. Treten diese Symptome auf, sollte der Serumkaliumspiegel vor der Dialyse gemessen und dokumentiert werden. Bei Patienten mit einem prädialytischen Kalium von >6mmol/l sollte die tägliche Aufnahme auf 50-70 mmol (1950-2730 mg) oder 1 mmol/kg/d begrenzt werden11. Wenn das Kalium wiederholt zu hoch ist, sollte der Patient angehalten werden, seine Kaliumaufnahme zu reduzieren, durch Vermeiden von kaliumreichen Früchten und Gemüse (Bananen, Orangen, Kartoffeln, Tomaten usw.) und dafür weniger kaliumhaltige Lebensmittel wählen (Äpfel, Birnen, Salat, Karotten, gekochtes Gemüse, Konservenfrüchte oder gekocht und zerkleinert).
Table 10.3. Steps to Calculate the initial binder prescription22.
| Maßnahme | Beispiel | Beispiel |
|---|---|---|
| Phosphataufnahme | Gesamtaufnahme an Phosphat | 1000 proTag oder 7000/Woche |
| Aufgenommene Menge (50-70% gemischte Ernährung ohne Nierenerkrankung) (53% renal vs. 77% nicht-renal) |
Nahrungsaufnahme multipliziert mit 50-60% absorbiert | 600 pro Tag oder 4200/Woche |
| Durchschnittliche HD/PD Clearance HD = 800 pro Therapie PD=300-315 pro Tag |
Aufgenommene Menge - Dialyse Clearance = verbleibendes P, dass durch Phosphatbinder gebunden werden muss | HD: 4200-2400 = 1800 mg P/Woche oder 257 mg/d PD: 4200-2205 = 1995 mg P/Woche oder 285 mg/d |
| Unterteilt in zu erwartende Bindungskraft oder nach Wahl des P-Binders | RVerbleibende P/Bindungskraft 257/39 (ca. P Bindung von 1g CaCO3) = 6.5 g CaCo3 | 257/45 (ca. P Bindung von 1g Calcium Acetat)- 5.7 g 257/15-30 (ca. P Bindung von 1 Al(OH)3 Tablette = 12-17 Tabletten 257/64 (ca. P Bindung von 800mg Sevelamer HCI) = 4 Tabletten 257/32 (ca. P Bindung pro 400mg Sevelamer HCL) = 8 Tabletten Hinweis: Kalkulationen für OD würde man 285 nutzen anstelle von 257 |
Hinweis: Die obenstehende Tabelle gibt Schätzungen auf Grundlage beschriebener Phosphatresorption, die durchschnittliche Clearence durch die Dialyse und das ungefähre Bindungspotential von Phosphatbindern wieder. Die Dosis sollte überwacht und an die individuellen Bedürfnisse der Patienten angepasst werde.
10.2.5.3 Phosphat
Hyperphosphatämie ist verbunden mit einem Hyperparathyriodismus, Kalzifizierung und einer Knochenstoffwechselstörung. Deshalb sollte der Phosphatspiegel engmaschig kontrolliert werden. Bei HD Patienten kann es durch den Bedarf an Eiweiß zu einer Akkumulation von Phosphat kommen, da bei jeder einzelnen Dialyse nur 500-700 mg entfernt werden. Eiweißreiche Nahrungsmittel stellen 12-16 mg Phosphat/g bereit, wobei Milchprodukte den höchsten Gehalt aufweisen11. Die Auswahl von eiweißreichen Nahrungsmitteln mit einem geringen Phosphatgehalt kann hilfreich bei der Erreichung des Phosphataufnahmeziels sein, ohne auf das wertvolle Eiweiß verzichten zu müssen.
Wird die Frequenz der HD erhöht, kann der Phosphatspiegel einfacher im Normbereich gehalten werden. Die Patienten haben größere Freiheiten bei der Wahl ihrer Nahrungsmittel. Bei Patienten, die ihr Phosphatziel nicht erreichen, können Phosphatbinder – Art, Dosis und Einnahmezeit – helfen, das Ziel zu erreichen. In Tabelle 10.3 sind die Schritte zur Kalkulation der Phosphatbinder bei CHD beschrieben. In Tabelle 10.4 wurden die gebräuchlichsten Phosphatbinder aufgelistete. Die Kontrolle des Phosphatspiegels darf auf keinen Fall zu Einschränkungen der Eiweißaufnahme führen. Übereinstimmend mit den Ernährungsleitlinien wird eine Phosphataufnahme von 800-1000 mg oder <17 mg/kg/d empfohlen4,11.
Bei der nächtlichen Heim Hämodialyse (NHHD) werden ca. 5638 mg Phosphat pro Woche entfernt. Das ist auf die erhöhte Frequenz und die Dauer der Therapie zurückzuführen. Aus diesem Grund können so Phosphatspiegel, bei großzügigen Ernährungsvorschriften, im Normbereich ohne oder nur mit einer Minimaldosis von Phosphatbindern erreicht werden. Die kurze tägliche Heim Hämodialyse (SDHD) entfernt etwas mehr Phosphat als die CHD. Die Verbesserung des Appetits bei der SDHD und die konsequente Einhaltung der empfohlenen Eiweißzufuhr führen zu einer positiven Netto-Phosphatbilanz23. Um eine Hyperphosphatämie zu vermeiden, sollten Phosphatbinder eingesetzt werden.
In Tabelle 10.4 sind die gebräuchlichsten Phosphatbinderverbindungen zusammengestellt.
Tabelle 10.4 Phosphatbinderverbindungen22.
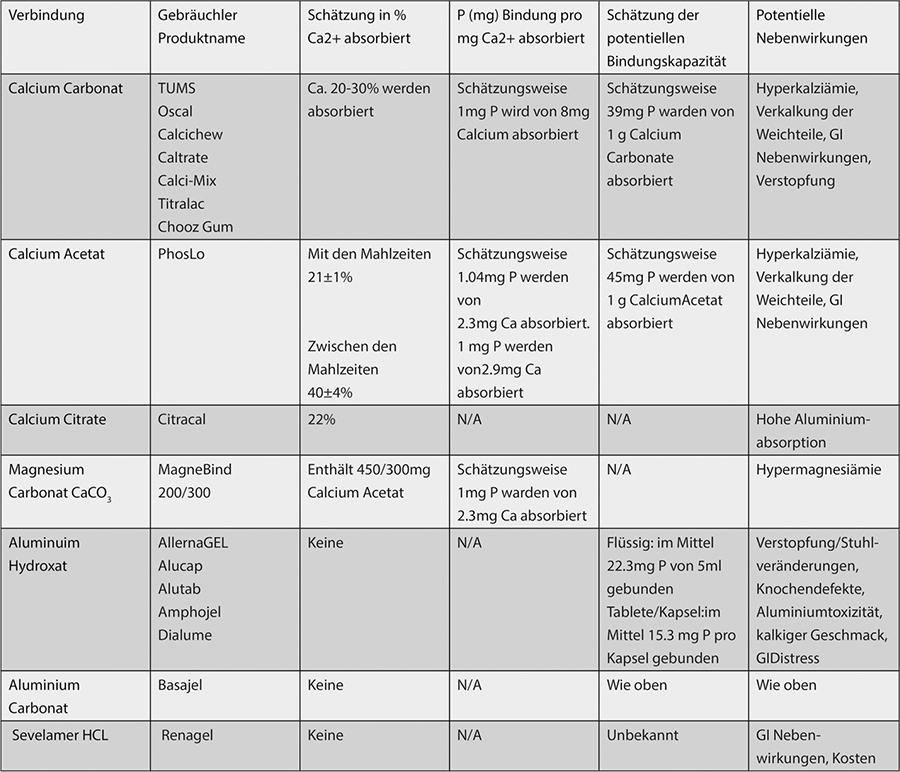
Zusammenfassung
Ernährung ist sehr wichtig für die FHHD Patienten. Mehr Dialyse bedeutet weniger starke Einschränkungen. Kalium, Phosphat, Flüssigkeit, Eiweiß und Vitamine sind wichtige Bestandteile. Jeder Patient sollte auf ihn angepasste Ernährungsinformationen erhalten, bezogen auf sein Ernährungsvorlieben und den Blutwerten.
Lernaktivitäten
- Was sind die Hauptgründe für eine Malnutrition bei CKD Patienten?
- Welche biologischen Marker sollten beobachtet werden, um frühzeitig eine Malnutrition zu erkennen?
- Wie hoch ist der Energiebedarf eines HD Patienten?
- Wie hoch ist der Eiweißbedarf eines FHHD Patienten?
EDTNA/ERCA Sekretariat
Email: secretariat@edtnaerca.org



