







Kalliopi-Anna Poulia
Dr, MSc, PhD
Clinical Nutritionist-Dietitian
Laiko General Hospital of Athens, Greece
lpoulia@gmail.com
10.0 Gestion de la diététique en hémodialyse à domicile
But de l'apprentissage
- Comprendre l'importance de la nutrition chez les patients en HDD
- Identifier les besoins nutritionnels d'un patient au stade 5 de l'IRC
- Identifier les différences entre les besoins nutritionnels d'un patient en HDD plus fréquente par rapport à l'hémodialyse conventionnelle
- Identifier comment les problèmes nutritionnels courants peuvent être pris en charge chez les patients en HDD
Introduction
La diététique est d’une grande importance pour les patients atteints d’une insuffisance rénale chronique (IRC), et pour l’issue de la maladie et pour la prévention ou le traitement de la malnutrition (sur- et sous-nutrition), assez fréquente chez les patients en IRC. La malnutrition désigne un état nutritionnel dans lequel une carence ou un déséquilibre énergétique en protéines et en d’autres nutriments entraîne des effets néfastes mesurables sur les tissus corporels (forme, taille et composition corporelles), sur les fonction et les résultat cliniques1. La première et la plus importante est la malnutrition protéinée-énergétique (MPE) ou gaspillage d’énergie protéique (GEP), qui se manifeste par un manque d’énergie dû à une déficit de protéines pour répondre aux besoins métaboliques de l’organisme2.
Les causes de la malnutrition sont:
- Un apport alimentaire inadéquat secondaire à l’anorexie causé par de l’urémie et par une altération de la sensation gustative.
- Une demande accrue en raison d’une maladie ou d’une affection aiguë.
- Une capacité diminuée pour préparer la nourriture
- Des régimes prescrits non appétissant (faible teneur en sel, en potassium, en phosphore, ou en restriction hydrique).
- La procédure de dialyse elle-même en raison des pertes de nutriments (peptides protéiques, vitamines solubles dans l’eau, etc.).
- Un hyper métabolisme dû à une inflammation chronique.
- Des troubles endocriniens causés parl’urémie3,4.
Par conséquent, une évaluation nutritionnelle détaillée est d’une importance primordiale pour fournir les meilleurs soins aux personnes atteintes à l’un ou l’autre stade d’IRC. Classiquement, trois grands axes d’investigation, à savoir les mesures biochimiques, l’apport alimentaire et l’état corporel, sont utilisés pour évaluer l’état nutritionnel protéine-énergie.
La consommation de protéines est d’une importance majeure, car l’HD provoque des déficiences en la matière. Un apport suffisant de protéines de haute valeur biologique doit être inclus. En même temps, le contrôle du phosphate nécessite l’utilisation correcte de liants phosphatés. De plus, une restriction de sodium est indispensable pour contrôler la soif, la consommation de liquide et pour faciliter le relevé de la pression artérielle. Enfin, le contrôle du potassium est d’une importance majeure, et est réalisé principalement par la restriction des choix alimentaires riches en potassium, principalement à partir des fruits et des légumes.
La prise en charge diététique des patients subissant une hémodialyse à domicile dépend du type d’hémodialyse suivi par les patients. Pour les patients suivant un programme d’HDD de trois fois trois à quatre heures par semaine, les restrictions alimentaires restent les mêmes qu’en HD conventionnelle. En augmentant la fréquence et la durée de l’hémodialyse à domicile (Hémodialyse Courte (HDDC) ou Hémodialyse Nocturne (HDDN)), on accroît l’élimination des déchets produits par le corps du patient. Par conséquent, la plupart des restrictions existantes pour l’HD conventionnelle peuvent être diminuées.
10.1 Contrôle biochimique en hémodialyse plus fréquente
En raison de la forte disposition à la malnutrition après le début de la maladie, une mesure de référence est utile pour le suivi de l’état nutritionnel. Au début de l’HDD, l’état nutritionnel peut déjà être influencé négativement par les restrictions alimentaires de l’HD conventionnelle ou même par l’adhérence à des régimes alimentaires restrictifs dans les stades précoces de l’IRC.
La perte de poids involontaire, qui atteint 5% de la masse corporelle en 3 mois, est considérée comme une perte de poids significative et doit servir d’alerte afin de prévenir la dénutrition. En outre, un appétit limité, un faible taux de phosphore, de cholestérol et d’albumine doivent être détectés rapidement et les patients doivent être encouragés à augmenter leur consommation énergétique et protéiniques.
Selon les données disponibles, après seulement quelques semaines d’initiation à l’hémodialyse fréquente (HDDF), l’appétit et l’apport alimentaire croissent, entraînant une augmentation des taux d’albumine et une amélioration de l’état nutritionnel5,8. Néanmoins celui-ci doit être étroitement surveillé chez les patients où l’on a détecté une altération précoce de cet état. Ceci est important selon le Tableau 10.1, pour un traitement précoce de cette malnutrition.
Les directives peuvent varier modérément et chaque unité pourra suivre ses propres directives. Selon KDOQI pour l’INR9, le sérum albumine <4 g/dl, le pré-albumine <30 mg/dl, la créatinine pré-dialyse<10 mg/dl et le cholestérol <150 mg/dl sont des marqueurs cliniquement utiles qui indiquent une forte présomption de sous-nutrition protéine-énergétique chez les patients atteints d’IRC, alors que la Société Internationale de nutrition et de métabolisme rénal incluait récemment l’albumine sérique <3,8 g/dl comme une des trois critères diagnostiques biochimiques pour la perte d’énergie protéique (parmi les niveaux de transthyrétine et de cholestérol)10. De plus, suivants les lignes directrices d’EBPG sur la nutrition11, l’IMC devrait être de >23 kg/m2 chez les patients en hémodialyse. Ces paramètres doivent être surveillés régulièrement, c’est-à-dire tous les mois, pour évaluer les résultats nutritionnels et les besoins des patients.
Tableau 10.1: Stratégies suggérées pour surveiller l’état nutritionnel et guider la thérapie dans les cas avancés d’IRC12
| Evaluación (mensual) simple | Résultats | Posibles intervenciones |
| Masse corporel / Masse corporelle idéale Albumine sérique Créatinine sérique |
Diminution continue ou <85% IBW <4.0 g/dl Valeurs de pré-dialyse relativement faibles |
Suspecter GEP et donner des détails évaluation nutritionnelle Prévoir des mesures préven-tives |
| Évaluation précoce détaillée | Résultats | Interventions simples pos-sibles |
| Préalbumine sérique Transferrine sérique Masse maigre et/ou masse grasse SGA: Évaluation globale subjective |
<30mg/dl et/ou <200mg/dl et/ou Diminution inattendue Détérioration |
Conseils diététiques: Apport en protéines 1,2g/kg/d, apport énergétique 30-35 Kcal / jour Augmenter la dose de dialyse à Kt/V>1.4 Utiliser des membranes bio-compatibles Améliorer la motilité gastro-intestinale supérieure |
| Répéter l'évaluation détaillée (2 – 3 mois plus tard) | Résultats | Interventions plus complexe possible |
| Pré albumine sérique Transferrine sérique Masse maigre et/ou masse grasse Protéine C-réactive |
<30mg/dl et/ou <200mg/dl et/ou Diminution inattendue >10 mg/l |
Appui nutritionnel (nutrition orale) Compléments, nutrition parenté-rale intra-dialytique (NPID) si nécessaire Facteurs anabolisants Stimulants de l'appétit (expéri-mental) Anti-inflammatoire (expérimen-tal) |
10.2 Apport nutritionnel – une accumulation moindre entraîne une plus grande liberté alimentaire
En raison de la fréquence accrue de la dialyse, HDDF peut fournir une fonction plus «physiologique» pour les patients, leur permettant d’excréter les déchets de métabolisme plus efficacement. Par conséquent, les restrictions appliquées aux patients subissant une HD conventionnelle, principalement pour le contrôle des électrolytes, c’est-à-dire le phosphate et le potassium, et la restriction du contrôle des liquides peuvent être réduites, selon les résultats sanguins sériques du patient. Récemment, les patients en HDDF chez KIHDNEy, présentaient des paramètres minéraux et osseux stables avec moins de restrictions alimentaires, et plus de patients se situaient dans la plage cible du phosphate et présentaient une amélioration significative des taux de bicarbonate par rapport aux valeurs initiales24.
L’apport nutritionnel peut être mesuré en calories pour l’énergie ou en grammes pour les protéines, et est généralement exprimé par kilogramme de masse corporel par jour (kcal/kg/jour ou g/kg/jour).
10.2.1 Apport énergétique
Un apport énergétique de 35 KCAL/kg/jour est essentiel pour atteindre un bilan azoté positif et est recommandé chez les patients stables atteints d’IRC stables dans les limites de leur masse corporelleidéale ± 10%13. En HD, chez un patient chronique cliniquement stable, cet apport est de 30-40 kcal/kg/jour, ajusté en fonction de son âge, de son sexe et du niveau connu de son activité physique. Pour les patients de plus de 60 ans ou obèses, l’apport énergétique ne doit pas dépasser 30 kcal/kg/jour9,11,14.
Les patients en surpoids ou sous-alimentés peuvent avoir besoin d’ajustements en énergie pour assurer une meilleure couverture de leurs besoins. L’apport énergétique pour les patients de plus de 60 ans devrait être de 30 kcal/kg/jour en raison de leurs besoins énergétiques réduits s’ils ont une vie plus sédentaire en raison de l’âge9. Cependant, une activité physique régulière devrait être encouragée car elle aide à maintenir la fonctionnalité des muscles et améliore l’endurance et la santé cardiovasculaire.
10.2.2 Apport en protéines
Les besoins en protéines chez les patients sous HD dépassent les besoins des personnes normales en bonne santé car le traitement de dialyse lui-même induit des pertes significatives de nutriments, en particulier les acides aminés, les oligopeptides, les vitamines hydrosolubles et les oligoéléments. De plus, le processus de dialyse est catabolique, induisant un stress catabolique et une libération de cytokines pro-inflammatoires qui augmentent les besoins en protéines15.
Selon les directives disponibles;
- L’apport protéique recommandé est de 1,0 à 1,5 g/kg/jour chez les patients hémodialysés chroniques cliniquement stables et chez les patients dont l’azote protéique normalisé est d’au moins 1,0 g/masse corporelle/jour.
- L’apport protéique optimal pour un patient en dialyse d’entretien souffrant d’une maladie aiguë est d’au moins 1,2 à 1,3 g/kg/jour4,11.
- Plus spécifiquement, pour les patients en HDD, les besoins en protéines sont d’une grande importance car la fréquence accrue de la dialyse augmente la perte de protéines.
Par conséquent, le niveau le plus élevé de recommandations doit être appliqué pour les patients en HDDF. Généralement, on a constaté que l’apport en protéines s’améliore après l’augmentation de la fréquence de la dialyse, avec une augmentation subséquente de l’apport en phosphates, sans altérer le taux de ceux-ci dans le sang, même avec une réduction potentielle de l’utilisation des liants phosphatés16. Néanmoins, la consommation de protéines est d’une importance majeure et doit être surveillée de près pour assurer une couverture suffisante des besoins des patients.
L’apport en protéines doit avoir une valeur biologique élevée, c’est-à-dire provenant de sources animales, par ex. viande de volaille, viande, blancs d’œufs, soja, fromage à la crème etc..Chez l’HDDF, les protéines animales riches en phosphore (petits poissons, produits laitiers, fromage, viande proche des os) peuvent généralement être plus largement consommées, comparées à l’HD conventionnelle où les déchets du métabolisme des protéines sont excrétés plus efficacement. En cas de mauvais contrôle des phosphates, la consommation d’aliments riches en phosphates de protéines doit être limitée et les protéines ne doivent être consommées que pendant les repas lorsque le patient prend des liants phosphatés, afin de limiter directement l’absorption du phosphore par l’intestin.
Si une altération du goût des protéines animales est signalée (goût métallique), d’autres sources de protéines à haute valeur biologique doivent être fournies. L’enrichissement de la nourriture avec des suppléments de protéines pourrait être un moyen de réaliser une augmentation de ces dernières.
10.2.3 Apport en graisse
L’IRC augmente le risque de développer une maladie cardiovasculaire17, en raison d’une inflammation, d’un rapport calcium/phosphore perturbé et de facteurs de risque préexistants tels que le diabète. Par conséquent, tous les facteurs de risque cardiovasculaires liés à la nutrition doivent être pris en compte18,19. Chez les patients en HD, l’accent doit être mis sur la qualité de leur apport en graisses;
- Les graisses saturées doivent être limitées à <10% de l’apport énergétique total.
- Le cholestérol <250 mg/jour.
- Les graisses mono-insaturées devraient représenter de 10 à 20% de la consommation totale d’énergie (CTE).
- Les graisses polyinsaturées doivent fournir environ 10% de CTE.
Il convient donc d’éviter les sources de graisses saturées, comme les produits laitiers, les fromages, les viandes grasses, les volailles avec peau, les aliments frits, le beurre et la crème grasse, tandis que l’huile d’olive doit être l’une des principales sources de graisse. L’accent devrait être mis sur l’apport en acides gras ω-3, qui peut faire partie du plan alimentaire chez les patients en HDD avec une augmentation de la fréquence ou de la durée, en raison d’un meilleur contrôle des niveaux de phosphate. La prise de poisson gras, comme la morue ou le saumon, peut être incluse au moins une fois par semaine, avec utilisation correcte de liants phosphatés chez les patients ayant un mauvais contrôle du phosphate.
10.2.4 Vitamines et oligo-éléments
Les patients dialysés sont enclins à développer des carences en vitamines en raison d’un métabolisme rénal anormal, d’un apport alimentaire inadéquat et d’un respect de restrictions alimentaires strictes, d’une perte d’absorption gastro-intestinale et de déficiences dues à la dialyse. Ces manques dépendent du type de dialyse et de sa durée, car la dialyse à flux élevé et à haute efficacité atténue les pertes en vitamines hydrosolubles. Les carences en vitamines se développent lentement, mais elles peuvent affecter la qualité de vie des patients. L’état vitaminique de chaque patient doit être évalué sur une base individuelle, en fonction de l’âge, du sexe, de l’apport alimentaire, des pertes par la dialyse, de la fonction rénale résiduelle et du type de dialyse avant toute thérapie vitaminique supplementaire11. Les niveaux de vitamine sanguine, ainsi que la détection précoce des symptômes de carences en vitamines, sont importants pour assurer la personnalisation du traitement.
10.2.4.1 Vitamines solubles dans l’eau
Au cours de l’hémodialyse, une quantité importante de vitamines est perdue dans le dialysat. En HD conventionnelle, en raison des restrictions diététiques potassiques dans les légumes et les fruits, les patients sont particulièrement sujets aux carences en acide folique et en vitamine C. La prise d’acide folique (1mg-5mg) est nécessaire pour la prévention de l’hyper-homocystéinémie. La vitamine C doit également être prise comme supplément (75-90 mg), considération la plus importante chez ceux qui limitent leur consommation en légumes et en fruits11.
La carence en thiamine est fréquente chez les patients hémodialysés car elle est facilement éliminée par l’HD et en même temps, l’apport alimentaire est souvent insuffisant. Les sources alimentaires de thiamine comprennent les graines, les légumineuses et le porc. Le béribéri est l’affection la plus connue causée par cette carence ; d’autres manifestations comprennent des symptômes neurologiques (encéphalite de Wernicke). Actuellement, tous les suppléments de vitamines pour les patients rénaux comprennent de la thiamine11.
La carence en rivoflabine n’est pas fréquente, même si elle est bien diluée lors d’une séance d’hémodialyse, car ses principales sources sont la viande maigre, les œufs, les céréales alimentaires dont le pain, et finalement des aliments inclus dans le régime alimentaire des patients atteints d’IRC.
Les besoins en vitamines B6 peuvent être augmentés par l’érythropoïèse accélérée par l’utilisation de l’érythropoïétine. La B12 est nécessaire pour la prévention de l’anémie pernicieuse et pour un métabolisme optimal de l’acide folique. Des quantités suffisantes se trouvent dans la viande, le lait et le jaune d’œuf, et une prise supplémentaire est sans danger chez les patients rénaux, l’apport est généralement proche des « Apports Nutritionnels de Référence »11.
Les recommandations concernant l’apport en vitamines et les suppléments pour les patients hémodialysés sont résumées au tableau 10.2. Il n’y a pas de recommandations spécifiques pour les patients subissant l’HDDF et d’autres recherches seront nécessaires afin d’identifier les différences dans les besoins en vitamines pour les patients en HD selon les différents types et la fréquence du traitement.
10.2.4.2 Vitamines liposolubles
Les vitamines liposolubles doivent être abordées avec précaution, car elles sont stockées dans l’organisme et le risque de toxicité est plus élevé. Les carences en vitamine A sont rares chez les patients rénaux car elles ne sont pas éliminées par hémodialyse. Par conséquent, le danger de toxicité est plus élevé et une utilisation supplémentaire n’est pas recommandée. Les besoins quotidiens peuvent être couverts par des sources alimentaires qui comprennent les produits laitiers, l’huile de poisson et les carottes. En ce qui concerne la vitamine K, carence chez les patients atteints d’IRC recevant un apport alimentaire suffisant n’a été constatée11.
Tableau 10.2. Apport alimentaire et suppléments de vitamines recommandés11
| Vitamines | Recommandations quotidiennes |
|---|---|
| Vitamines solubles dans l'eau | |
| Thiamine (B1) | 1.1-1.2 mg supplément |
| Riboflzavine (B2) | 1.1-1.3 mg supplément |
| Niacine (B3) | 14-16 mg supplément |
| Acide pantothénique (B5) | 5 mg supplément |
| Pyridoxine (B6) | 10 mg supplément |
| Biotine (B8) | 30 μg supplément |
| Acide folique (B9) | 1-5 mg supplément |
| Cobalamine (B12) | 2.4 mg supplément |
| Vitamine C | 75-90 mg supplément |
| Vitamines liposolubles | |
| Vitamine A | Apport 700-900 μg intake - pas de supplément |
| Vitamine K | 90-120 μg - pas de supplément |
| Vitamine E | 400-800 IU supplément pour prévention des maladies cardiovasculaires secondaires et des crampes |
10.2.5 Électrolytes et minéraux
10.2.5.1 Sodium et fluides
La restriction sodique est indiquée pour tous les stades de l’IRC car elle est essentielle pour le contrôle du volume extracellulaire et pour une meilleure vérification de la pression artérielle. En HD, le contrôle du sodium est encore plus important, car il facilite le respect des restrictions hydriques et prévient le gain de masse interdialytique chez les patients anuriques et oliguriques, étant donné qu’il réduit la soif. Les substituts de sel contenant du chlorure de potassium doivent être évités. Le sel peut être remplacé par l’utilisation d’herbes et d’épices. Plus précisément, le sodium ne doit pas dépasser 80-100 mmol (2000-3000 mg) ou 5-6 g (75 mg/kg/jour).
L’apport liquidien, est généralement plus libre chez les patients utilisant l’HDDF à la maison, car plus de fluides sont éliminés au cours de la semaine.
Par conséquent, de nombreux patients peuvent dépasser la limite de 500-1000 ml en plus de la production quotidienne d’urine. Il n’y a pas de recommandations strictes pour l’apport hydrique chez les patients en HDDF, mais le but est de contrôler le gain pondéral interdialytique11.
Chez les patients qui ont du mal à contrôler leur consommation de liquide, tous les aliments liquides à température ambiante (18-20°) doivent être comptés comme liquides, à l’exception des huiles. Le contrôle de la soif peut être facilité par la réduction du sel, la consommation de liquides réfrigérés, celle de glaçons à la place de l’eau, l’ajout de citron dans l’eau et l’utilisation de chewing-gums pour hydrater la bouche20,21.
10.2.5.2 Potassium
Chez les sujets en bonne santé, 90% du potassium alimentaire est excrété par les reins. Ceux qui sont en dialyse limitant l’apport alimentaire et qui reçoivent une dialyse adéquate peuvent atteindre des niveaux de potassium acceptables. Le potassium existe dans presque tous les aliments, de sorte que les restrictions sévères doivent être limitées, afin d’assurer un équilibre entre l’alimentation et la qualité de vie des patients.
Chez la majorité des patients traités par une augmentation de la fréquence de l’HDD, les niveaux de potassium sont maintenus plus facilement dans les limites des niveaux normaux. Par conséquent, l’alimentation peut être moins restrictive, en termes de consommation de fruits et de légumes. L’apport en fibres est également plus facile à maintenir dans les quantités recommandées, ce qui facilite la défense contre la constipation. Chez les patients atteints d’IRC, l’excrétion intestinale de potassium est augmentée en tant que mécanisme de compensation et les précautions prises contre la constipation contribue également à la prévention de l’hyperkaliémie.
L’hyperkaliémie provoque des nausées, une faiblesse, un engourdissement ou un picotement, un pouls lent, des battements de cœur irréguliers et un risque élevé d’insuffisance cardiaque ou de mort subite. Après l’un de ces signes, les taux de potassium sérique doivent être mesurés et documentés avant l’HD. Chez les patients en pré-dialyse présentant un taux de potassium supérieur à 6 mmol / l, l’apport quotidien en potassium ne doit pas dépasser 50-70 mmol (1950-2730 mg) ou 1 mmol / kg / jour11. Si les taux de potassium sont élevés, il faut conseiller aux patients de réduire leur consommation en fruits et légumes riches en potassium (bananes, oranges, pommes de terre, tomates, etc.) et en choisissant des fruits plus faibles contenant moins de cette substance (pommes, poires, laitues, carottes, etdes légumes bouillis, des fruits pelés ou bouillis et du haché).
Tableau 10.3. Étapes pour calculer la prescription initiale du liant22.
| Étape | Cas | Exemple |
|---|---|---|
| Apport en phosphate | Apport total par l'alimentation | 1000 par jour ou 7000 par semaine |
| Quantité absorbée (50-70% de régime mixte dans non-rénal) (53% rénaux vs 77% non rénaux) |
Apport alimentaire multiplié par 50-60% absorbé | 600 par jour ou 4200 par semaine |
| Moyenne d'élimination HD / PD HD = 800 par traitement PD = 300-315 par jour |
Quantité absolu - d'éliminationpar la dialyse = P restant doit être lié par liant phosphaté | PD: 4200-2205 = 1995 mg P/wk or 285 mg/day PD: 4200-2205 = 1995 mg P/semaine ou 285 mg/jour |
| Division par la puissance de liaison estimée ou le liant de choix | P restant / force de liaison 257/39 (quantité de P lié par 1 g de CaCO3) = 6,5 g de CaC03 |
257/45 (quantité de P lié par 1g calcium acétate) = 5.7 g (quantité de P lié par 1 g de CaCO3) = | 257/15-30 (quantité de P lié par 1AI(OH)3 tablette) = 12-17 tablettes 257/64 (quantité de P lié par 800mg sevelamerHCI) = 4 tablettes 257/32 (quantité de P lié par 400mg sevelamerHCI) = 8 tablettes Remarque: Les calculs pour OD utiliseraient 285 au lieu de 257 |
Remarque: Le tableau ci-dessus estime la prescription initiale basée sur l’absorption moyenne du phosphore, l’élimination moyenne de la dialyse et le potentiel de liaison approximatif pour le liant de choix. La dose doit être surveillée et ajustée en fonction de la réponse de chaque patient.
10.2.5.3 Phosphate
L’hyperphosphatémie est liée à l’hyperparathyroïdie, à la calcification et aux maladies osseuses minérales. Par conséquent, le phosphate sérique doit être étroitement surveillé. Chez les patients en HD, des besoins élevés en protéines peuvent conduire à une accumulation de phosphore, car chaque séance d’HD ne supprime que 500-700 mg de phosphate. Les aliments protéinés fournissent 12-16 mg de phosphate/g, tandis que les produits laitiers possèdent la teneur la plus élevée11. La sélection d’aliments protéiques ayant la teneur la plus faible en phosphore peut aider à atteindre les objectifs en matière de phosphate, sans affecter l’apport en protéines.
Quand la fréquence de l’hémodialyse est augmentée, les niveaux de phosphate peuvent être maintenus dans les niveaux normaux plus facilement, et donc les patients sont autorisés à suivre un plan diététique plus relâché. Chez les patients qui n’atteignent pas leurs objectifs en matière de phosphates, l’utilisation appropriée de liants phosphatés – type, dose et durée – augmentera l’excrétion du phosphore. Dans le tableau 10.3, les étapes de calcul de la prescription initiale de liant sont décrites pour l’HD classique et dans le tableau 10.4, les principaux composés de liaison au phosphate sont listés. Il est important que le contrôle du phosphate ne compromette pas l’apport en protéines. Selon les recommandations nutritionnelles existantes, un apport en phosphate de 800-1000 mg ou <17mg/kg/jour est recommandé4,11.
L’hémodialyse nocturne à domicile (HDDN) élimine environ 5638 mg de phosphore par semaine, attribué à l’augmentation de la fréquence et à la durée de la dialyse. Ce fait libère le régime des patients qui peuvent contrôler leurs niveaux de phosphate avec l’utilisation minimale ou pas de liants phosphatés. L’hémodialyse quotidienne courte à domicile (HDDC) élimine un peu plus de phosphate que l’HD conventionnelle; Cependant, l’amélioration de l’appétit chez les patients en HDDC et l’augmentation conséquente de l’apport en protéines et en phosphore laissent généralement les patients avec une balancede phosphate nettement positive23. En cas d’hyperphosphatémie, l’utilisation de liants phosphatés doit être envisagée.
Dans le tableau 10.4, les principaux composés se liant au phosphate sont présentés.
Table 10.4. Phosphate binding compounds22.
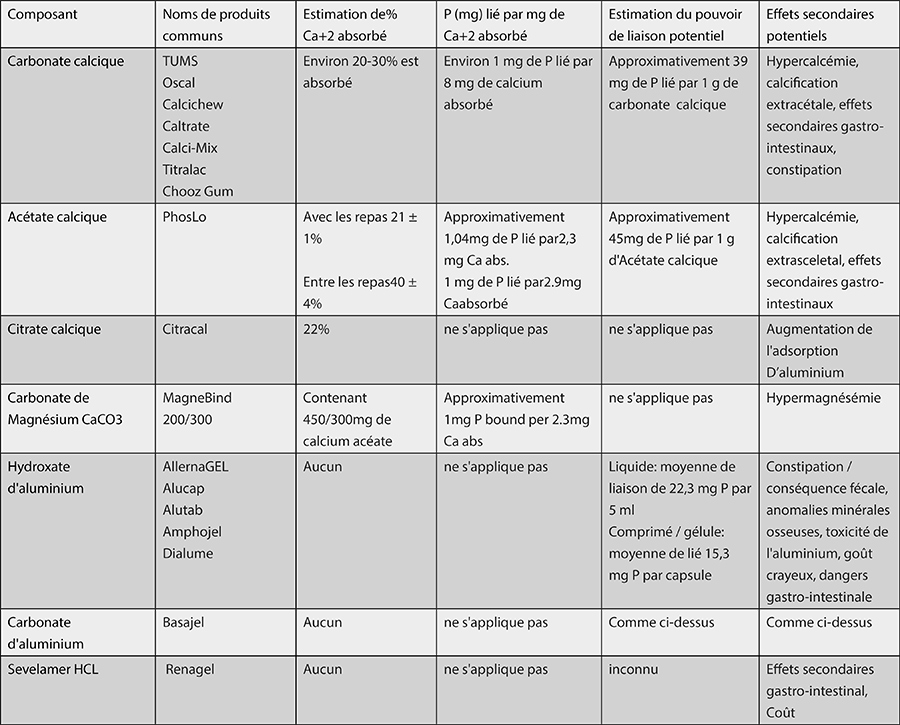
Résumé
La nutrition est très importante pour les personnes traitées par l’HDDF, même si plus de dialyse signifie moins de restrictions. Le potassium, le phosphate, les liquides, les protéines et les vitamines sont tous des éléments importants. Chaque patient doit recevoir des informations personnalisées en fonction de ses besoins quotidiens, de ses préférences alimentaires et de ses résultats sanguins.
Apprentissage
- Quelles sont les principales causes de malnutrition chez les patients atteints d’IRC?
- Quels marqueurs biologiques doivent être surveillés pour la détection précoce de la malnutrition durant l’hémodialyse?
- Quels sont les besoins énergétiques des patients en HD?
- Quels sont les besoins en protéines pour les patients en HDD fréquente?
- Décrivez 5 différences dans le régime alimentaire d’un patient lorsqu’il passe de l’hémodialyse conventionnelle à l’hémodialyse à domicile.
EDTNA/ERCA Secrétariat
E-mail: secretariat@edtnaerca.org



